Estados de la materia
uando se piensa en la materia,
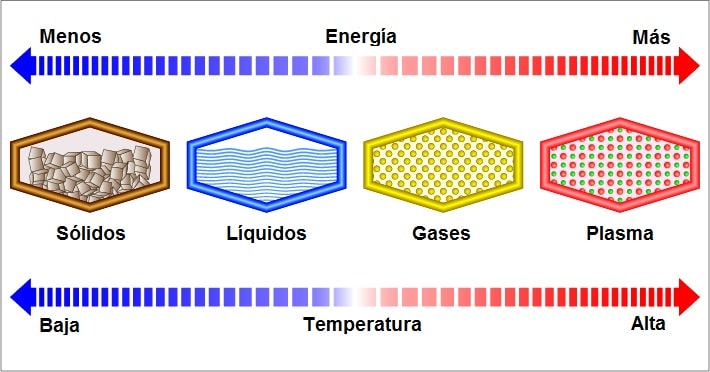
se suele asumir que existen tres estados en los que puede tener forma:
sólido, líquido y gaseoso. En efecto, se trata de los tres más usuales y
los llamados ‘tres estados de agregación’, aunque hay un cuarto llamado plasma que solo se puede presentar bajo una temperatura extremadamente alta, dejando átomos dispersos.
Los tres estados de agregación convencionales son
los que la química analiza habitualmente, con algunas pocas sustancias
que pueden aparecer en las tres formas: el mejor ejemplo de esto es el agua.
Cambios de estado de agregación: Una cuestión muy interesante de los estados de agregación de la materia es que existe la posibilidad que se pase de cualquiera de los tres estados a cualquier otro, no siendo necesaria la mediación de ningún estado.
Algunas características del estado gaseoso
Cambios de estado de agregación: Una cuestión muy interesante de los estados de agregación de la materia es que existe la posibilidad que se pase de cualquiera de los tres estados a cualquier otro, no siendo necesaria la mediación de ningún estado.
 A la transformación de sólido a líquido se le denomina fusión y a su inversa solidificación.
A la transformación de sólido a líquido se le denomina fusión y a su inversa solidificación. A la transformación de líquido a gaseoso se le denomina vaporización y a su opuesto condensación.
A la transformación de líquido a gaseoso se le denomina vaporización y a su opuesto condensación. A la transformación de sólido en gaseoso se le denomina sublimación y a su opuesto sublimación inversa.
A la transformación de sólido en gaseoso se le denomina sublimación y a su opuesto sublimación inversa.

Sólidos
Los sólidos son los que están compuestos de partículas que están unidas en forma estrecha. Las partículas pueden moverse pero en un grado muy pequeño, pues la condición fundamental es que los sólidos no se difundan ni fluyan.Características de los sólidos
- Los sólidos se caracterizan por tener poca elasticidad, por lo que una vez deformados no recuperan su forma original por sí mismos.
- La forma y el volumen es constante, y no se pueden comprimir por lo que no se puede reducir su volumen presionándolos. Sin embargo, los sólidos suelen dilatarse y contraerse; aumentar de volumen cuando son calentados y reducirlo cuando se enfrían.
- La subdivisión habitual que se realiza respecto de los sólidos se hace entre los cristalinos (que tienen una estructura atómica regular) y los amorfos (que están formados por partículas ordenadas en forma irregular).
Ejemplos de sólidos
Los siguientes constituyen una lista de ejemplos de elementos en estado sólido. Sal de mesa
Sal de mesa Diamante
Diamante Hielo
Hielo Ámbar
Ámbar Azufre
Azufre Cuarzo
Cuarzo Perlas
Perlas Hierro
Hierro Azúcar
Azúcar Plásticos duros
Plásticos duros
 Magnetita
Magnetita Caolín
Caolín Madera
Madera Arena
Arena Grafito
Grafito Feldespato
Feldespato Yeso
Yeso Carbón
Carbón Silicio
Silicio Calcopirita
Calcopirita
Líquidos
Los líquidos son sustancias que también tienen un ordenamiento estrecho de las partículas. Sin embargo, aquí las fuerzas de atracción son más débiles por lo que estas partículas se mueven y chocan entre sí, vibrando y deslizándose unas sobre las otras.Características de los líquidos
- Los líquidos puedan tener una densidad similar a los sólidos, pero a su vez se adaptan y fluyen, teniendo siempre la forma del recipiente que los contiene.
- La viscosidad es una característica que les es propia, pero en distinta medida según el caso.
- Otras propiedades típicas del estado líquido es la tensión superficial (dado por las fuerzas de atracción en todas las direcciones) y la capilaridad (la facilidad de los líquidos para subir por tubos de escaso diámetro).
Ejemplos de líquidos (estado líquido)
La siguiente lista incluye ejemplos de sustancias líquidas: Agua
Agua Glicerina
Glicerina Acetona
Acetona Leche
Leche Formol
Formol Vinagre
Vinagre Metal fundido
Metal fundido Aceite comestible
Aceite comestible Aceite de girasol
Aceite de girasol Jugos de frutas
Jugos de frutas
 Tolueno
Tolueno Cristal líquido
Cristal líquido Ácido fosfórico
Ácido fosfórico Líquido encefalorraquídeo
Líquido encefalorraquídeo Benceno
Benceno Saliva
Saliva Cloroformo
Cloroformo Petróleo
Petróleo Alcohol etílico
Alcohol etílico Mercurio
Mercurio
Gases
El estado gaseoso de la materia es marcadamente distinto a los otros dos. Las fuerzas de atracción son casi inexistentes, por lo que las partículas están sumamente separadas entre ellas.Algunas características del estado gaseoso
- El movimiento que realizan es rápido y descontrolado, trasladándose incluso a largas distancias: esto es lo que explica que el gas adopte el tamaño y la forma del lugar que ocupa.
- La densidad de los distintos tipos de gases es mucho más pequeña que la de los líquidos y los sólidos, y los gases son rápidamente comprensibles.
- Las leyes de los gases, aportadas por Charles y Gay-Lussac constituyeron las propiedades más importantes de los gases, referentes a la relación entre las presiones y la temperatura de los gases.
Ejemplos de estado gaseoso (gases)
La siguiente lista expone ejemplos de sustancias típicamente encontradas bajo estado de agregación gaseoso: Oxígeno
Oxígeno Hidrógeno
Hidrógeno Vapor de agua
Vapor de agua Nitrógeno
Nitrógeno Argón
Argón Helio
Helio Monóxido de carbono
Monóxido de carbono Cloro
Cloro Flúor
Flúor Butano
Butano
 Ozono
Ozono Metano
Metano Nubes del cielo
Nubes del cielo Amoníaco
Amoníaco Eter
Eter Kriptón
Kriptón Gas lacrimógeno
Gas lacrimógeno Neón
Neón Globos de gas
Globos de gas Gas sulfhídrico
Gas sulfhídrico
Comentarios
Publicar un comentario