Termodínamica
¿Qué estudia la termodinámica?
La termodinámica proviene de dos disciplinas separadas hasta el S.XIX, la termología y la mecánica. La primera se encargaba de los fenómenos exclusivamente térmicos y la segunda trataba el movimiento, la fuerza y el trabajo.
La termodinámica es la parte de la física que estudia las transferencias de calor, la conversión de la energía y la capacidad de los sistemas para producir trabajo. Las
leyes de la termodinámica explican los comportamientos globales de los
sistemas macroscópicos en situaciones de equilibrio.
- Se aplica al estudio de sistemas que contienen muchas partículas y no al estudio de moléculas, átomos o partículas subatómicas
- Estudia el sistema en situaciones de equilibrio, que son aquellas a las que sistema tiende a evolucionar y caracterizadas porque en ellas todas las propiedades del sistema quedan determinadas por factores intrínsecos y no por influencias externas previamente aplicadas
- Sus postulados son indemostrables, están basados en las experiencias y no en razonamientos teóricos
Componentes de un sistema termodinámico
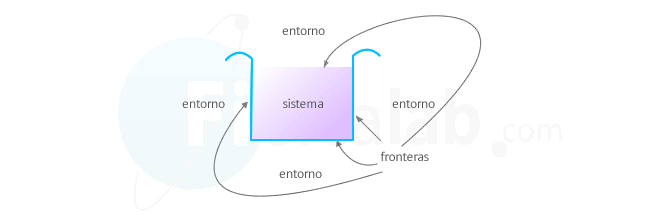
Sistema
El sistema es la parte del universo que vamos a estudiar. Por ejemplo, un gas, nuestro cuerpo o la atmósfera son ejemplos de sistemas que podemos estudiar desde el punto de vista termodinámica.Entorno o ambiente
Todo aquello que no es sistema y que se sitúa alrededor de él, se denomina ambiente o entorno. Los sistemas interaccionan con el entorno transfiriendo masa, energía o las dos cosas. En función de ello los sistemas se clasifican en:| Tipo | Intercambia | Ejemplo |
|---|---|---|
| Abierto | Masa y energía (trabajo o calor) | Reacción química en tubo de ensayo abierto |
| Cerrado | Sólo energía | Radiador de calefacción |
| Aislado | Ni materia ni energía | Termo para mantener bebidas a temperatura constante |
| Adiabático | Ni materia ni calor, pero si energía en forma de trabajo | Termo con tapa que permita variar volumen |
Frontera o paredes del sistema
A través de ellas se comunica el sistema con el entorno. Existen los siguientes tipos:- Fijas: Mantienen el volumen constante
- Móviles: El volumen es variable y depende de la presión en el lado del sistema y de la del entorno
- Conductoras o diatérmanas: Al conducir calor permiten que la temperatura a ambos lados de la misma sea igual
- Adiabáticas: No conducen calor. Son los aislantes térmicos
Variables y ecuación de estado
Las variables de estado son el conjunto de valores que adoptan ciertas variables físicas y químicas y que nos permiten caracterizar el sistema. A las variables de estado también se las llama funciones de estado. No todos los sistemas termodinámicos tienen el mismo conjunto de variables de estado. En el caso de los gases son:- presión
- volumen
- masa
- temperatura
La ecuación de estado de los gases ideales sigue la expresión:
Donde:
Donde:
- p : Presión. Su unidad de medida en el Sistema Internacional es el pascal ( Pa ) aunque también se suele usar la atmósfera ( atm ). 1 atm = 101325 Pa
- V : Volumen. Su unidad de medida en el Sistema Internacional es metro cúbico ( m3 ) aunque también se suele usar el litro ( l o L ). 1 L = 1 dm3 = 10-3m3
- n : Número de moles. Se trata de una unidad de masa. Un mol de una sustancia se compone del número de Avogadro, NA = 6.023·1023 de moléculas de esa sustancia, y su peso coincide con la masa molecular de la sustancia expresada en gramos. La unidad de medida en el Sistema Internacional para el número de moles es el mol ( mol )
- R : Constante universal de los gases. Su valor en unidades del Sistema Internacional es R = 8.31 J / mol·K, aunque también se usa R = 0.083 atm·l / mol·K
- T : Temperatura. Su unidad de medida en el Sistema Internacional es el kelvin ( K ) aunque también se suele usar el grado centígrado o celsius ( ºC ). T = tC + 273.15
Finalmente, decimos que un sistema ha alcanzado el estado de equilibrio cuando sus variables de estado permanecen constantes. Todas las propiedades del sistema en equilibrio quedan determinadas por factores intrínsecos y no por influencias externas previamente aplicadas. La termodinámica sólo se ocupa de sistemas en estado de equilibrio.
Variables intensivas y extensivas
- Intensivas: Son aquellas que no dependen del tamaño del sistema. Por ejemplo la presión, la temperatura, la concentración o la densidad
- Extensivas: Son aquellas que dependen del tamaño del sistema. Por ejemplo el volumen, la masa o la energía
Las leyes de la termodinámica
Las leyes de la termodinámica son principios empíricos que no se pueden demostrar por estar basados en la experiencia y no en razonamientos teóricos. Están referidos a sistemas en estado de equilibrio. Son cuatro, aunque los más importantes son el primero y el segundo:- Principio cero de la termodinámica
- Primer principio de la termodinámica
- Segundo principio de la termodinámica
- Tercer principio de la termodinámica
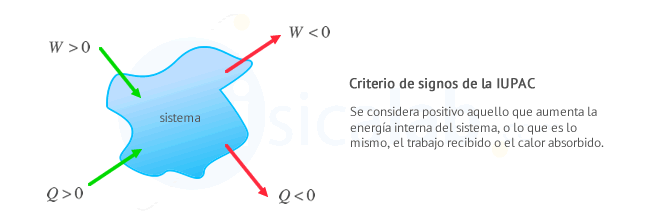
Criterio de signos en termodinámica
Existen dos criterios de signos ampliamente extendidos en termodinámica para relacionar el trabajo y el calor que intercambia un sistema con el entorno:-
Criterio de la IUPAC: Se considera positivo todo lo que aumenta la energía del sistema, es decir, calor recibido y trabajo recibido
-
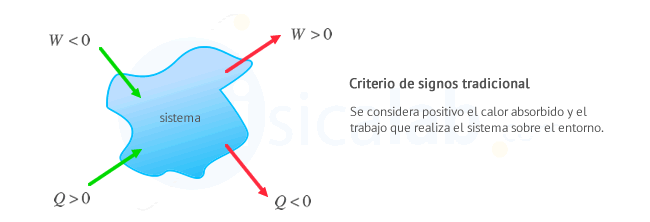
Criterio Tradicional: Se considera positivo el calor recibido por el
sistema y el trabajo que realiza el sistema sobre el entorno. Este
criterio es util en el estudio de máquinas térmicas en el que interesa
que el trabajo realizado por las máquinas (el sistema) sea positivo
Comentarios
Publicar un comentario